




內容提要
歐盟限制線型含釓對比劑的使用
澳大利亞提示含釓對比劑的腦部釓沉積風險
英國警示達利珠單抗重度肝損傷風險
英國警示超適應癥使用苯達莫司汀可導致死亡率增加
歐盟限制線型含釓對比劑的使用
2017年7月21日,歐洲藥品管理局(EMA)發布消息稱,其已經完成對含釓對比劑(GBCA)的評估,確認在磁共振成像掃描中限制使用某些線型GBCA,并暫停其他線型GBCA的上市許可。EMA人用藥品委員會在評估后發現,使用GBCA后可造成釓在腦組織中的沉積,因此提出以上建議。
目前尚無證據表明腦部釓沉積會對患者造成任何傷害,但是EMA已建議限制使用某些靜脈用線型GBCA,以防止可能與腦部釓沉積相關的任何風險。
3種線型GBCA仍可上市使用。釓塞酸(Gadoxetic acid)和釓貝酸(Gadobenic acid)可繼續用于肝臟掃描,因為其被肝臟吸收并滿足重要的診斷需求。另一個是直接注射到關節部位的釓噴酸(Gadopentetic acid),其釓濃度極低,可繼續用于關節掃描。同時,建議暫停其他靜脈用線型GBCA(釓雙胺、釓噴酸和釓弗塞胺)在歐盟上市。
另一類稱為環型的GBCA(釓布醇、釓特酸和釓特醇),比線型GBCA更穩定且釋放釓的傾向較低。這些產品可以繼續用于當前適應癥,但應使用獲得清晰圖像的最低劑量,且僅在非增強掃描不適用時才能使用。
EMA稱,若相關企業可提供證據,表明在某些特定患者中使用線型GBCA的獲益遠高于腦沉積風險,或者能夠完善產品,使其不會顯著釋放釓或在身體組織中引起釓沉積,則可以解除線型GBCA的暫停或限制使用措施。
患者須知
● GBCA可幫助在人體掃描時向患者提供清晰的體內圖像。
● 使用GBCA掃描后,少量釓可在腦部沉積,但目前尚無證據表明這些少量釓可引起任何傷害。
● 作為預防措施,醫生將停止使用部分靜脈內使用的GBCA,某些其他GBCA也僅在其他制劑不適用時使用,例如在肝臟掃描時。
● GBCA對于診斷危及生命和致殘性疾病至關重要。
● 如果掃描需要使用GBCA,醫生將使用獲得清晰圖像的最低劑量。
醫務人員須知
● 腦部釓沉積已通過質譜分析以及在腦組織中信號增強得到證實。
● 可靠的數據以及體外和非臨床研究已表明,線型GBCA從配體分子釋放釓的程度遠大于環型GBCA。
● 目前,尚未發現任何GBCA腦部釓沉積引起的神經系統不良反應,如認知或運動障礙。
● 靜脈使用的線型藥物釓雙胺和釓弗塞胺,以及線型藥物的靜脈內制劑釓噴酸的上市許可已在歐盟暫停。
● 兩種靜脈使用的線型藥物(釓塞酸和釓貝酸)仍可繼續可用,因為這些藥物經肝臟吸收,可用于成像較差的肝血管病變,尤其在延遲相成像中。其他試劑還沒有在此方面進行充分研究。
● 線型藥物釓噴酸的關節內制劑仍可繼續使用,因為此類掃描所需的釓劑量非常低。
● 所有環型GBCA——釓布醇、釓特酸和釓特醇均可繼續使用。
● 醫務人員只有在非增強掃描不適用的情況下才能使用GBCA。
● 醫務人員應始終使用能提供充分診斷的增強掃描的最低劑量。
● 歐盟市場上保留的GBCA的產品信息將進行相應更新。
(EMA網站)
澳大利亞提示含釓對比劑的腦部釓沉積風險
2017年7月28日,澳大利亞治療產品管理局(TGA)評估了含釓對比劑(GBCA)的最新信息,告知消費者和醫務人員在磁共振成像掃描過程中使用GBCA后,少量釓可能會沉積在腦中。目前尚未確定大腦中釓沉積的有害影響,但TGA正在與這些產品的生產企業合作,修改產品安全性信息。
GBCA注射到患者的靜脈中,可以增強內臟器官、血管和組織的磁共振成像掃描質量。磁共振成像掃描可幫助醫務人員診斷疾病狀況。GBCA有兩種類型:線型和環型。已發表的研究發現,與環型GBCA相比,線型GBCA可能會在大腦中產生更多的釓沉積。TGA將繼續監測上述風險,必要時采取進一步措施。
TGA告之患者和醫務人員,釓在腦中沉積僅與磁共振成像掃描中使用的GBCA有關,不涉及用于其他成像程序的其他類型的對比劑。GBCA的產品信息中曾提示釓“不會穿過完整的血腦屏障”,在某些情況下,釓不會在正常腦組織中蓄積。現在越來越多的證據表明這可能發生。
雖然目前尚未發現大腦中釓沉積的有害影響,但TGA和生產企業正在更新產品信息,并建議審慎使用GBCA,尤其是線型GBCA。TGA建議在必須使用GBCA的情況下,應使用最低有效劑量,并謹慎選擇GBCA種類。TGA還建議除非臨床必須,應避免重復使用這些對比劑進行掃描。
參考文獻:
● Cao, Y, Huang,DQ, Shih, G, & Prince, MR (2016). Signal Change in the Dentate Nucleus onT1-Weighted MR Images After Multiple Administrations of GadopentetateDimeglumine Versus Gadobutrol. AJR Am J Roentgenol, 206, 414-9.
● Flood TF,Stence NV, Maloney JA, Mirsky DM. (2016) Pediatric Brain: Repeated Exposure toLinear Gadolinium-based Contrast Material Is Associated with Increased SignalIntensity at Unenhanced T1-weighted MR Imaging. Radiology. Jul 28:160356.
● Kanda, T,Ishii, K, Kawaguchi, H, Kitajima, K, & Takenaka, D (2014). High signalintensity in the dentate nucleus and globus pallidus on unenhanced T1- weightedMR images: relationship with increasing cumulative dose of a Gd-based contrastmaterial. Radiology, 270, 834-41.
● Kanda T,Fukusato T, Matsuda M, Toyoda K, Oba H, Kotoku J, et al. (2015a). Gd-basedContrast Agent Accumulates in the Brain Even in Subjects without Severe RenalDysfunction: Evaluation of Autopsy Brain Specimens with Inductively CoupledPlasma Mass Spectroscopy. Radiology 2015 Jul;276(1):228- 232.
● Kanda, T,Osawa, M, Oba, H, Toyoda, K, Kotoku, J, Haruyama, T, Takeshita, K, & Furui,S (2015b). High Signal Intensity in Dentate Nucleus on Unenhanced T1-weightedMR Images: Association with Linear versus Macrocyclic Gd ChelateAdministration. Radiology, 275, 803-9.
● Mcdonald, RJ,Mcdonald, JS, Kallmes, DF, Jentoft, ME, Murray, DL, Thielen, KR, Williamson,EE, & Eckel, LJ (2015). Intracranial Gd Deposition after Contrast-enhancedMR Imaging. Radiology, 275, 772-82.
● Murata N,Gonzalez-Cuyar LF, Murata K, Figner C, Dills R, Hippe D, & Maravilla KR(2016). Macrocyclic and Other Non-Group 1 Gd Contrast Agents Deposit Low Levelsof Gd in Brain and Bone Tissue: Preliminary Results From 9 Patients With NormalRenal Function. Invest Radiol. 2016 Feb 8.
● Radbruch, A,Weberling, LD, Kieslich, PJ, Eidel, O, Burth, S, Kickingereder, P, Heiland, S,Wick, W, Schlemmer, HP, & Bendszus, M (2015a). Gd retention in the dentatenucleus and globus pallidus is dependent on the class of contrast agent.Radiology, 275, 783-791.
● Ramalho, J,Semelka, RC, Alobaidy, M, Ramalho, M, Nunes, RH, & Castillo, M (2016).Signal intensity change on unenhanced T1-weighted images in dentate nucleusfollowing gadobenate dimeglumine in patients with and without previous multipleadministrations of gadodiamide. Eur Radiol. 2016 Feb 24.
(澳大利TGA網站)
英國警示達利珠單抗重度肝損傷風險
2017年7月20日,英國藥品和醫療產品管理局(MAHR)發布信息稱,正在緊急評估歐洲范圍內有關達利珠單抗(Daclizumab,商品名Zinbryta)的肝臟安全性,以及評估接受治療的患者情況,并要求達利珠單抗僅用于治療選擇有限的患者,同時密切監測肝功能。
達利珠單抗150mg注射液于2016年7月在歐盟獲準上市,用于治療成人復發性多發性硬化癥,目前在英國主要用于臨床試驗。英國國家健康和保健醫學研究所(NICE)與蘇格蘭醫療聯合體于2017年4月發布了達利珠單抗的使用建議。
建議醫務人員對患者進行評估。醫務人員應盡快評估目前正在接受達利珠單抗治療的所有患者,以確定他們是否適合繼續使用該藥品,包括與患者討論風險。如果患者不在限制的適應癥范圍內或未達到預期療效,則考慮停止治療。患者在接受達利珠單抗治療期間以及末次給藥后4個月內,醫生應經常關注臨床表現和監測肝功能(血清轉氨酶和膽紅素水平),至少每月一次。密切觀察患者肝損傷的體征和癥狀。如果有肝損傷證據(臨床或實驗室檢查),應停止治療并立即轉診至肝病專家。
達利珠單抗僅限于在以下患者中使用:(1)對至少一種疾病修飾療法失敗的高度活動性復發性多發性硬化癥。(2)不適合與其他疾病修飾療法聯合治療的重度復發性多發性硬化癥。
目前,達利珠單抗對已有肝臟疾病或肝損傷的患者禁用,對丙氨酸氨基轉移酶或天冬氨酸氨基轉移酶為正常值上限兩倍或以上的患者不推薦使用。
有自身免疫性疾病(多發性硬化癥除外)病史的患者不推薦使用。同時服用具有潛在肝毒性藥品時應謹慎使用該藥,包括非處方藥和草藥補充劑。
歐洲范圍內對達利珠單抗啟動的緊急評估源于一項正在開展的觀察性研究,在這項研究中發生1例肝損傷死亡病例(暴發性肝衰竭)以及4例嚴重肝損傷病例。在歐盟批準達利珠單抗上市時肝損害為已知風險。盡管已采取多項措施控制該風險,包括要求定期監測肝功能,以及向醫務人員和患者提供關于肝損害風險的教育材料。然而,盡管治療前和治療期間肝功能監測結果均在正常范圍內,仍出現了死亡病例。
關于肝損害風險現有的建議包括:與患者討論肝損害風險,并向其提供患者卡;告知患者如果發生任何肝損害癥狀,如不明原因的惡心、嘔吐、腹痛、疲勞、食欲減退、皮膚和眼睛發黃以及深色尿,應立即聯系醫生;在轉氨酶或總膽紅素升高的情況下,可能需要中斷或中止治療(見達利珠單抗產品特征概要,具體如下表所示)。
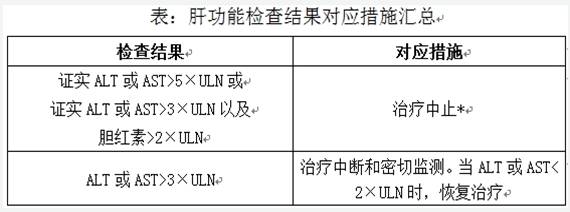
*如果發現其他病因,數值恢復正常,或者恢復治療對患者的獲益超過風險,則可考慮重新啟動治療。ALT:丙氨酸氨基轉移酶。AST:天冬氨酸氨基轉移酶。ULN:正常值上限。
MHRA將公開發布信函告知醫務人員:迅速評估目前正在接受治療的患者情況,僅用于治療選擇有限的多發性硬化患者,以及密切監測肝功能的必要性。該評估一旦完成,MHRA將提供進一步信息。
(英國MHRA網站)
英國警示超適應癥使用苯達莫司汀可導致死亡率增加
2017年7月20日,英國藥品和醫療產品管理局(MHRA)發布消息稱,近期臨床試驗證據表明,超適應癥使用苯達莫司(Bendamustine,商品名Levact)進行聯合治療可導致死亡率增加。
苯達莫司汀的獲批適應癥為:
1. 慢性淋巴細胞白血病(Binet B期或C期)的一線治療,適用于不宜進行氟達拉濱聯合化療者;
2. 單獨用于治療惰性非霍奇金淋巴瘤,適用于利妥昔單抗或含利妥昔單抗方案治療期間或治療后6個月內病情進展者;
3. 與潑尼松聯合使用作為多發性骨髓瘤(Durie-SalmonⅡ期進展或Ⅲ期)的一線治療,適用于不具備自體干細胞移植條件,且在確診時患有臨床神經病變、限制了沙利度胺或含硼替佐米藥品使用的65歲以上患者。
近期針對未獲批適應癥的臨床試驗數據顯示:苯達莫司汀與利妥昔單抗或奧妥珠單抗聯合使用時存在安全風險,死亡率有所增高。報告的死亡主要是與細菌性感染(敗血癥、肺炎)和機會性感染(如卡氏肺囊蟲肺炎、水痘-帶狀皰疹病毒感染、巨細胞病毒感染)有關,同時也報告了部分致死性心臟毒性、神經毒性和呼吸系統毒性事件。歐洲上市后數據分析結果顯示:苯達莫司汀治療發生機會性感染的風險高于既往認知。現有信息顯示,使用苯達莫司汀后發生感染的頻率和結局取決于臨床條件,差異極大。頻繁出現機會性感染可能與淋巴細胞減少和CD4陽性T細胞計數低相關。在接受苯達莫司汀治療后,有相當比例的患者出現了最短持續7-9個月的淋巴細胞減少(<600個/L)和CD4陽性T細胞計數低(<200個/L)。與利妥昔單抗聯合使用時,上述現象更為多見。
該產品說明已更新,MHRA提醒公眾和醫護人員關注警示信息里有關機會性感染的部分。
MHRA建議:治療期間應全程監測患者的呼吸系統體征和癥狀;提醒患者及時報告新出現的感染征兆,包括發熱或呼吸系統癥狀;如果出現機會性感染的征兆,應考慮停止使用苯達莫司汀。
此外,已有慢性乙肝病毒攜帶者在使用苯達莫司汀后出現病毒再激活的報告,有患者因此導致急性肝衰竭或死亡。MHRA建議密切監測乙型肝炎病毒攜帶者活動性感染的體征和癥狀。
(MHRA網站)
以上全部內容均摘自國家藥品不良反應監測中心網站
 關注 · 廣州政府網
關注 · 廣州政府網